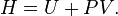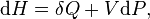Blog ini dibangun untuk memenuhi salah satu proyek matakuliah Termodinamika dengan Dosen Pengampu Bapak Apit Fathurohman, S. Pd., M. Si
Selasa, 17 Maret 2015
SIKLUS OTTO IDEAL
Siklus Otto adalah siklus ideal untuk mesin torak dengan pengapian-nyala bunga api.Pada mesin pembakaran dengan sistem pengapian-nyala ini, campuran bahan bakar dan udara dibakar dengan menggunakan percikan bunga api dari busi. Piston bergerak dalam empat langkah (disebut juga mesin dua siklus) dalam silinder, sedangkan poros engkol berputar dua kali untuk setiap siklus termodinamika. Mesin seperti ini disebut mesin pembakaran internal empat langkah. Skema berikut memperlihatkan setiap langkah piston dan pernyataan prosesnya pada diagram P-v untuk kondisi aktual mesin pengapian-nyala empat langkah,
Dari skema di atas tersebut, kondisi awal kedua katup hisap dan buang dalam keadaan tertutup sedangkan piston pada posisi terendahnya yaitu pada titik mati bawah (Bottom Dead Center/BDC). Selama langkah kompresi, piston bergerak ke atas, di mana campuran udara-bahan bakar dikompresi. Sesaat sebelum piston mencapai posisi tertingginya yaitu titik mati atas (Top Dead Center/TDC), percikan bunga api ditimbulkan oleh busi sehingga membakar campuran, yang kemudian menaikkan tekanan dan temperatur sistem. Tekanan gas yang tinggi tersebut mendorong piston ke bawah sehingga menyebabkan poros engkol berputar, selama langkah usaha (langkah ekspansi) ini dihasilkan kerja keluaran yang bermanfaat. Pada ujung langkah ini, piston pada posisi terendahnya untuk menyelesaikan siklus yang pertama (mesin satu siklus), sehingga isi silindernya berupa sisa pembakaran.
Piston bergerak kembali ke atas membersihkan gas buang melalui katup buang (langkah pembuangan), kemudian piston turun kembali ke bawah mengambil campuran udara-bahan bakar yang baru melalui katup hisap (langkah hisap). Sebagai catatan bahwa tekanan dalam silinder di atas tekanan lingkungan saat langkah buang dan berada di bawah tekanan lingkungan saat langkah hisap.
Analisis termodinamika untuk kondisi aktual tersebut dapat disederhanakan bila digunakan asumsi udara-standar yang berlaku sebagai gas-ideal. Karenaitu, siklus untuk kondisi aktual dimodifikasi menjadi sistem tertutup yang disebut sebagai siklus Otto ideal. Skema dan pernyataan prosesnya pada diagram P-v dan T-s seperti terlihat pada gambar berikut,
Siklus Otto ideal terdiri dari empat proses reversibel internal, yaitu proses 1-2 kompresi isentropik, proses 2-3 penambahan kalor pada volume tetap, proses 3-4 ekspansi isentropik, dan proses 4-1 pelepasan kalor pada volume tetap. Karena siklus Otto ideal ini merupakan sistem tertutup, maka ada beberapa asumsi yang digunakan yaitu (1) mengabaikan perubahan energi kinetik dan potensial, dan (2) tidak ada kerja yang timbul selama proses perpindahan kalor.
Kapasitas Kalor
Kapasitas kalor gas adalah banyaknya kalor yang dibutuhkan untuk menaikkan suhu gas sebesar 1°C, untuk volume tetap disebut CV dan untuk tekanan tetap disebut Cp.
Secara matematis, kapasitas kalor (C) dinyatakan dengan persamaan :
C = Q/ΔT (1–18)
Pada gas, perubahan suhu dapat dilakukan dengan proses isobarik atau proses isokhorik. Dengan demikian, kapasitas kalor gas dapat dibedakan menjadi dua, yakni kapasitas kalor pada tekanan tetap (Cp) dan kapasitas kalor pada volume tetap (V). Perumusan kedua pada kapasitas kalor tersebut secara matematis dapat dituliskan sebagai berikut.
Cp = QP/ΔT dan CV = QV/ΔT (1–19)
Jika besaran QP dan QV dimasukkan ke dalam persamaan Hukum Pertama Termodinamika, akan didapatkan persamaan berikut.
a. Pada proses isokhorik
QV = ΔU + W (1–20)
Oleh karena dalam proses ini volume sistem tetap (ΔU = 0) maka usaha sistem W = 0 sehingga didapatkan persamaan :
QV = ΔU (1–21)
b. Pada proses isobarik
QP = ΔU + W
Oleh karena dalam proses ini tekanan sistem tetap ( Δp + 0), usaha sistem W = p ΔV. Dengan demikian, persamaan Hukum Pertama Termodinamika dapat dituliskan
QP = ΔU + p ΔV (1–22)
Dengan melakukan substitusi Persamaan (1–21) ke Persamaan (1–22) dapat dituliskan persamaan
Qp = ΔU + p ΔV atau Qp – QV = p ΔV (1–23)
Selanjutnya, jika Persamaan (9–19) disubstitusikan Persamaan (1–23) akan diperoleh persamaan
(Cp ΔT) – (CV ΔT) = p ΔV
(Cp CV)ΔT = p ΔV
Berdasarkan persamaan keadaan gas ideal pV = nRT, Persamaan (1–24) dapat dituliskan menjadi
Cp – CV = nR (1–25)
Untuk gas monoatomik, energi dalam gas dinyatakan dengan persamaan :
ΔU = 3/2 nRΔT
Dengan demikian, kapasitas kalor pada proses isokhorik (QV = ΔU) dapat dituliskan sebagai :
CV = 3/2 nR (9–26)
sumber : wikipedia
Senin, 16 Maret 2015
Hukum I Termodinamika
Jika kalor diberikan kepada sistem, volume dan suhu sistem akan bertambah (sistem akan terlihat mengembang dan bertambah panas). Sebaliknya, jika kalor diambil dari sistem, volume dan suhu sistem akan berkurang (sistem tampak mengerut dan terasa lebih dingin). Prinsip ini merupakan hukum alam yang penting dan salah satu bentuk dari hukum kekekalan energi.
Sistem yang mengalami perubahan volume akan melakukan usaha dan sistem yang mengalami perubahan suhu akan mengalami perubahan energi dalam. Jadi, kalor yang diberikan kepada sistem akan menyebabkan sistem melakukan usaha dan mengalami perubahan energi dalam. Prinsip ini dikenal sebagai hukum kekekalan energi dalam termodinamika atau disebut hukum I termodinamika. Secara matematis, hukum I termodinamika dituliskan sebagaiQ = W + ∆U
Dimana Q adalah kalor, W adalah usaha, dan ∆U adalah perubahan energi dalam. Secara sederhana, hukum I termodinamika dapat dinyatakan sebagai berikut.
Jika suatu benda (misalnya krupuk) dipanaskan (atau digoreng) yang berarti diberi kalor Q, benda (krupuk) akan mengembang atau bertambah volumenya yang berarti melakukan usaha W dan benda (krupuk) akan bertambah panas (coba aja dipegang, pasti panas deh!) yang berarti mengalami perubahan energi dalam ∆U.
Proses Isotermik
Suatu sistem dapat mengalami proses termodinamika dimana terjadi perubahan-perubahan di dalam sistem tersebut. Jika proses yang terjadi berlangsung dalam suhu konstan, proses ini dinamakan proses isotermik. Karena berlangsung dalam suhu konstan, tidak terjadi perubahan energi dalam (∆U = 0) dan berdasarkan hukum I termodinamika kalor yang diberikan sama dengan usaha yang dilakukan sistem (Q = W).Proses isotermik dapat digambarkan dalam grafik p – V di bawah ini. Usaha yang dilakukan sistem dan kalor dapat dinyatakan sebagai
Dimana V2 dan V1 adalah volume akhir dan awal gas.
Proses Isokhorik
Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada dalam volume konstan (∆V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV.QV = ∆U
Proses Isobarik
Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W = p∆V). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstan Qp. Berdasarkan hukum I termodinamika, pada proses isobarik berlakuSebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan
QV =∆U
Dari sini usaha gas dapat dinyatakan sebagai
W = Qp − QV
Jadi, usaha yang dilakukan oleh gas (W) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan (Qp) dengan energi (kalor) yang diserap gas pada volume konstan (QV).
Proses Adiabatik
Dalam proses adiabatik tidak ada kalor yang masuk (diserap) ataupun keluar (dilepaskan) oleh sistem (Q = 0). Dengan demikian, usaha yang dilakukan gas sama dengan perubahan energi dalamnya (W = ∆U).Jika suatu sistem berisi gas yang mula-mula mempunyai tekanan dan volume masing-masing p1 dan V1 mengalami proses adiabatik sehingga tekanan dan volume gas berubah menjadi p2 dan V2, usaha yang dilakukan gas dapat dinyatakan sebagai
Dimana γ adalah konstanta yang diperoleh perbandingan kapasitas kalor molar gas pada tekanan dan volume konstan dan mempunyai nilai yang lebih besar dari 1 (γ > 1).
Proses adiabatik dapat digambarkan dalam grafik p – V dengan bentuk kurva yang mirip dengan grafik p – V pada proses isotermik namun dengan kelengkungan yang lebih curam.
PENGUKURAN KAPASITAS PANAS
PENGUKURAN KAPASITAS PANAS
Kapasitas panas yang ada pada sebagian besar sistem tidaklah konstan, namun bergantung pada variasi kondisi dari sistem termodinamika. Kapasitas panas bergantung pada temperatur itu sendiri, dan juga tekanan dan volume dari sistem.
Berbagai cara untuk mengukur kapasitas panas dapat dilakukan, yang secara umum dilakukan pada kondisi tekanankonstan atau volume konstan. Sehingga simbol kapasitas jenisnya disesuaikan, menjadi Cp untuk kapasitas jenis pada tekanan konstan, dan CV untuk kapasitas jenis pada volume konstan. Gas dan cairan umumnya diukur pada volume konstan. Pengukuran pada tekanan konstan akan menghasilkan nilai yang lebih besar karena nilai tekanan konstan juga mencakup energi panas yang digunakan untuk melakukan kerja untuk mengembangkan volume zat ketika temperatur ditingkatkan.
Panas jenis spesifik dari suatu zat merupakan molekul yang tidak pada kondisi konstan melainkan bergantung pada temperaturnya. Temperatur pada lingkungan pengukuran yang dibuat biasanya juga ditentukan. Conth dua cara untuk menuliskan panas jenis dari suatu zat yaitu:
- Air (cair): cp = 4.1855 [J/(g·K)] (15 °C, 101.325 kPa) atau 1 kalori/gram °C
- Air (cair): CvH = 74.539 J/(mol·K) (25 °C)
Untuk cairan dan gas, penting untuk mengetahui tekanan yang digunakan dalam menuliskan nilai kapasitas panas. Kebanyakan data yang dipublikasikan dituliskan pada kondisi tekanan standar.
Hubungan termodinamika[sunting | sunting sumber]
Energi internal dari sebuah sistem tertutup akan berubah dengan menambahkan panas ke sistem atau ketika sistem melakukan kerja.
Untuk kerja sebagai hasil dari perubahan volume sistem:
Jika panas ditambahan pada volume konstan:
Jadilah kapasitas panas pada volume konstan, CV.
Untuk kapasitas panas pada tekanan konstan, CP, yang diturunkan dari persamaan perubahan entalpi:
Perubahan pada entalpi dapat dirumuskan dengan:
Sehingga pada tekanan konstan, didapatkan:
Hubungan antara kapasitas panas[sunting | sunting sumber]
Pengukuran kapasitas panas pada volume konstan seringkali sulit dilakukan pada benda berwujud padat dan cair, karena perubahan temperatur dapat membuat volume zat mengalami pemuaian sehingga membutuhkan penampung yang memiliki kekuatan yang sangat tinggi. Lebih mudah menghitung secara tekanan konstan dan lalu menurunkannya menggunakan persamaan termodinamika dasar.
Bisa juga dituliskan dengan:
di mana
 adalah koefisien pemuaian
adalah koefisien pemuaian adalah kompresibilitas isotermal
adalah kompresibilitas isotermal
Rasio kapasitas panas atau indeks adiabatik adalah rasio dari kapasitas panas pada tekanan konstan terhadap kapasitas panas pada volume konstan, yang dapat disebut juga sebagai faktor ekspansi isentropik.
Gas ideal[sunting | sunting sumber]
Untuk gas ideal, mengevaluasi persamaan turunan parsial di atas berdasarkan persamaan keadaan di mana R adalah konstanta gas ideal[1]
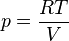 →
→ =
= 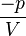
 →
→
Substitusikan
 =
= 
Sehingga akan didapatkan persamaan Mayer jika direduksi
Kapasitas panas spesifik (panas jenis)[sunting | sunting sumber]
Kapasitas panas spesifik (atau panas jenis) adalah kapasitas panas per basis massa
di mana pada ketiadaan transisi fase zat akan didapatkan panas jenis:
di mana
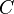 adalah kapasitas panas
adalah kapasitas panas adalah massa zat
adalah massa zat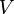 volume zat
volume zat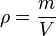 massa jenis zat
massa jenis zat
Untuk gas dan bahan lainnya yang berada pada tekanan tinggi, terdapat perbedaan nilai panas jenis pada kondisi yang berbeda. Kapasitas panas dapati didefinisikan dengan measukkan kondisi proses isobarik (tekanan konstan,  ) danproses isokhorik (volume konstan,
) danproses isokhorik (volume konstan,  ). Hubungan panas jenisnya dapat dirumuskan dengan:
). Hubungan panas jenisnya dapat dirumuskan dengan:
 ) danproses isokhorik (volume konstan,
) danproses isokhorik (volume konstan,  ). Hubungan panas jenisnya dapat dirumuskan dengan:
). Hubungan panas jenisnya dapat dirumuskan dengan:
Sesuai dengan persamaan sebelumnya:
Minggu, 15 Maret 2015
TENTANG TEMPERATUR
Temperatur adalah suatu ukuran aktivitas molekul. akan tetapi, dalam termodinamika klasik kuantitas-kuantitas yang didinginkan didefinisika hanya melalui observasi makroskopik, sehingga dengan demikian definisi temperatur melalui ukuran molekular tidak dapat dipergunakan. jadi kita harus melanjutkan analisis tanpa mendefinisikan temperatur dengan sebenarnya.
kesetaraan temperatur
biarkanlah dua benda terisolasi dari lingkungannya tapi letakkan bersentuhan satu dengan yang lainnya. jika yang satu lebih panas dari pada yang lainnya, benda yang lebih panas akan menjadi lebih dingin dan benda yang lebih dingin akan lebih panas, kedua benda tersebut akan mengalami perubahan sampai semua properti mereka (misalnya, tahanan listrik) berhenti berubah. ketika hal ini terjadi, kedua benda tersebut dikatakan telah mencapai kesetimbangan termal. jadi, kita menyatakan bahwa kedua sistem memiliki temperatur yang sama jika tidak ada perubahan pada propertinya ketika kedua sistem tersebut saling bersetuhan. dengan kata lain, jika dua sistem berada dalam kesetimbangan termal temperatur keduanya dipostulasikan bernilai sama.
ada suatu pengamatan jelas yang disebut hukum ke-nol termodinamika: jika dua sistem memiliki temperatur yang sam dengan suatu sistem ketiga, keedunanya memiliki temperatur yang sama.
skala temperatur relatif
untuk membuat suatu skala temperatur, kita memilih sejumlah subdivisi, yang disebut derajat, diantara dua titik yang tetap dan mudah diulangi, titik es dan titik uap. titik es (ice point) terjadi ketika es dan air berada dalam kesetimbangan pada tekanan 101 kPa; titik uap (steam point) terjadi ketika air cair dan uapnya berada dalam kesetimbangan pada tekanan 101 kPa. pada skala farenheit terdapat 180 derajat diantara kedua titik tersebut; pada skala celcius (yang resminya disebut centrigrade), terdapat 100 derajat. pada skala farenheit titik es diberikan 32 dan pada skala celcius diberikan nilai 0. nilai-nilai ini memungkinkan kita untuk menuliskan
kesetaraan temperatur
biarkanlah dua benda terisolasi dari lingkungannya tapi letakkan bersentuhan satu dengan yang lainnya. jika yang satu lebih panas dari pada yang lainnya, benda yang lebih panas akan menjadi lebih dingin dan benda yang lebih dingin akan lebih panas, kedua benda tersebut akan mengalami perubahan sampai semua properti mereka (misalnya, tahanan listrik) berhenti berubah. ketika hal ini terjadi, kedua benda tersebut dikatakan telah mencapai kesetimbangan termal. jadi, kita menyatakan bahwa kedua sistem memiliki temperatur yang sama jika tidak ada perubahan pada propertinya ketika kedua sistem tersebut saling bersetuhan. dengan kata lain, jika dua sistem berada dalam kesetimbangan termal temperatur keduanya dipostulasikan bernilai sama.
ada suatu pengamatan jelas yang disebut hukum ke-nol termodinamika: jika dua sistem memiliki temperatur yang sam dengan suatu sistem ketiga, keedunanya memiliki temperatur yang sama.
skala temperatur relatif
untuk membuat suatu skala temperatur, kita memilih sejumlah subdivisi, yang disebut derajat, diantara dua titik yang tetap dan mudah diulangi, titik es dan titik uap. titik es (ice point) terjadi ketika es dan air berada dalam kesetimbangan pada tekanan 101 kPa; titik uap (steam point) terjadi ketika air cair dan uapnya berada dalam kesetimbangan pada tekanan 101 kPa. pada skala farenheit terdapat 180 derajat diantara kedua titik tersebut; pada skala celcius (yang resminya disebut centrigrade), terdapat 100 derajat. pada skala farenheit titik es diberikan 32 dan pada skala celcius diberikan nilai 0. nilai-nilai ini memungkinkan kita untuk menuliskan
TF= 9/5 tC+ 32
TC= 5/9 (tF-32)
skala temperatur absolut
hukum kedua termodinamika memungkinkan kita untuk mendefinisikan suatu skala temperatur absolut; akan tetapi, karena saat ini kita belum memiliki hukum kedua tersebut sedangkan kita perlu segera menggunakan temperatur absolut, maka akan diberikan skala temperatur absolut empiris.
Hubungan temperatur absolut dan relatif adalah
TF= tF+ 459,67
TC= tC+273,15
dimana subskrip "F" mengacu pada skal farenheit dan subskrip "C" kepada skala celcius. (Nilai 460 dan 273 digunakan jika tingkat akurasi yang tepat tidak digunakan jika tingkat akuarsi yang tepat tidak diperlukan). temperatur absolut pada skala farenheit diberikan dalam derajat rankine (0R) dan pada skala celcius diberikan dalam kelvin (K). catatan 300 K dibaca "300 kelvin", bukan "300 derajat kelvin". kita tidak menggunakan simbol derajat untuk temperatur yang diukur dalam kelvin.
sumber :
termodinamika teknik edisi ke-2
ENTROPI
Entropi adalah salah satu besaran termodinamika yang mengukur energi dalam sistem per satuan temperatur yang tak dapat digunakan untuk melakukan usaha. Mungkinmanifestasi yang paling umum dari entropi adalah (mengikuti hukum termodinamika),entropi dari sebuah sistem tertutup selalu naik dan pada kondisi transfer panas, energi panas berpindah dari komponen yang bersuhu lebih tinggi ke komponen yang bersuhu lebih rendah.Pada suatu sistem yang panasnya terisolasi, entropi hanya berjalan satu arah (bukan prosesreversibel/bolak-balik). Entropi suatu sistem perlu diukur untuk menentukan bahwa energitidak dapat dipakai untuk melakukan usaha pada proses-proses termodinamika. Proses-prosesini hanya bisa dilakukan oleh energi yang sudah diubah bentuknya, dan ketika energi diubahmenjadi kerja/usaha, maka secara teoritis mempunyai efisiensi maksimum tertentu. Selamakerja/usaha tersebut, entropi akan terkumpul pada sistem, yang lalu terdisipasi dalam bentuk panas buangan.Formulasi Kelvin-Planck atau hukum termodinamika kedua menyebutkan bahwaadalah tidak mungkin untuk membuat sebuah mesin kalor yang bekerja dalam suatu siklusyang semata-mata mengubah energi panas yang diperoleh dari suatu reservoir pada suhutertentu seluruhnya menjadi usaha mekanik. Hukum kedua termodinamika mengatakan bahwa aliran kalor memiliki arah; dengan kata lain, tidak semua proses di alam semestaadalah reversible (dapat dibalikkan arahnya). Sebagai contoh jika seekor beruang kutubtertidur di atas salju, maka salju dibawah tubuh nya akan mencair karena kalor dari tubuh beruang tersebut. Akan tetapi beruang tersebut tidak dapat mengambil kalor dari saljutersebut untuk menghangatkan tubuhnya. Dengan demikian, aliran energi kalor memilikiarah, yaitu dari panas ke dingin. Satu aplikasi penting dari hukum kedua adalah studi tentangmesin kalor.Pada termodinamika klasik, konsep entropi didefinisikan pada hukum keduatermodinamika, yang menyatakan bahwa entropi dari sistem yang terisolasi selalu bertambahatau tetap konstan. Maka, entropi juga dapat menjadi ukuran kecenderungan suatu proses,apakah proses tersebut cenderung akan "terentropikan" atau akan berlangsung ke arahtertentu. Entropi juga menunjukkan bahwa energi panas selalu mengalir secara spontan daridaerah yang suhunya lebih tinggi ke daerah yang suhunya lebih rendah
Sabtu, 14 Maret 2015
KALOR
Pengertian
kalor berbeda dengan pengertian suhu. Suhu adalah derajat panas atau dinginnya
suatu benda, sedangkan kalor adalah energi yang dipindahkandari suatu benda ke
benda lainnya kerena perbedaan suhu/temperatur. Jika sebuah benda dipanaskan,
maka suhu/temperatur benda akan naik, sebaliknya jika benda didinginkan,maka
suhu/temperaturnya akan turun.
Kalor Jenis
Zat
Kalor jenis adalah banyaknya kalor yang diperlukan
oleh suatu zat untuk menaikkan suhu 1 kg zat tersebut sebesar 1oC.Berdasarkandefinisi
tersebut, maka hubungan antara banyaknya kalor yang diserapoleh suatu benda dan
kalor jenis benda, serta kenaikan suhu benda.
Alat yang digunakan untuk mengukur kalor jenis zat
adalah kalorimeter. Berdasarkan hasil percobaan, didapatkan bahwa perubahan
suhu yang diakibatkan oleh jumlah kalor yang sama pada zat yang berbeda adalah
tidak sama. Berikut adalah ilustrasi kalorimeter.Untuk melihatnya, tekanlah tombol
Kapasitas
Kalor
Untuk benda yang bermassa tetap, nilai mc pada
persamaan Q = m . c . ΔT memiliki nilai yang tetap pula. Nilai mc ini dapat
dipandang sebagai satu kesatuan, sehingga mc diberi nama khusus, yaitu
kapasitas kalor. Kapasitas kalor dapat diartikan sebagai kemampuanmenerima atau
melepaskan kalor dari suatu benda untuk perubahan suhu sebesar 10C.
Banyaknya kalor yang diperlukan untuk menaikkan
suhu/temperatur suatu benda sebanding dengan kapasitas kalor banda tersebut dan
perubahan suhunya.
Langganan:
Postingan (Atom)